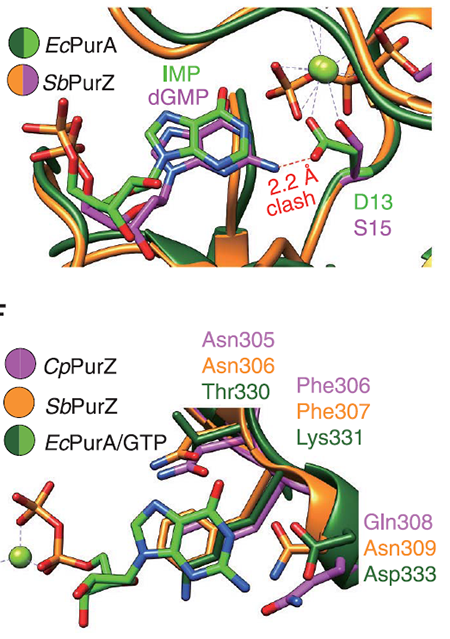
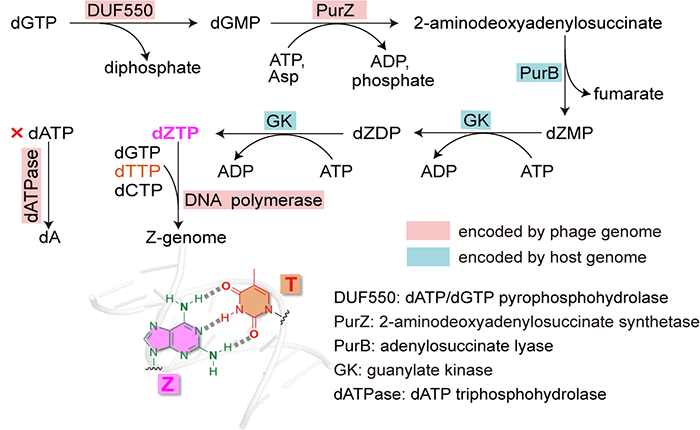
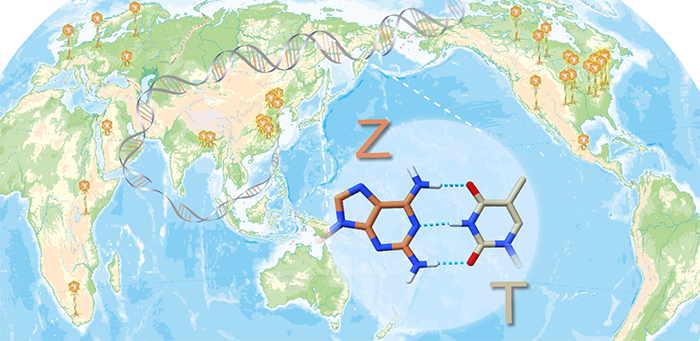
4月28日,Science杂志在线发表上海科技大学的赵素文研究员,天津大学的张雁教授和A*STAR/UIUC的赵惠民教授合作团队的研究成果:A widespread pathway for substitution of adenine by diaminopurine in phage genomes,揭示了Z-基因组生物合成通路。在本研究中,合作团队首先通过生物信息学分析对GenBank数据库中的数十个PurZ蛋白的序列进行了分析,发现它们和其远源同源蛋白PurA(催化AMP合成通路中的第一步,底物是IMP)相比,在活性口袋具有几处明显的区别:(1)PurA中是D13在PurZ中是S23,这个变化使得PurZ的活性口袋在这个位置可以容纳的底物比PurA要略大一些;(2)在决定底物是核糖核苷或是脱氧核糖核苷的残基位点,在PurA中是G298和K303,而在PurZ中是T273和L278。这些活性口袋内残基的变化使得PurZ可以用dGMP为底物,催化dZMP合成通路中的第一步。dZMP经过宿主激酶的处理即可生成DNA聚合酶所需的dZTP。接下来的问题是,在dZTP和dATP都存在的情况下,噬菌体编码的DNA聚合酶如何保证选择性地使用dZTP?合作团队在分析purZ的基因组邻近区时发现,purZ基因附近有两个磷酸酶在多个噬菌体中都存在。其中一个磷酸酶含有HD结构域,与其关系最近的有结构的同源物是磷酸水解酶OxsA(PDB ID:5TK7,序列相同度为18%)。OxsA具有水解dATP的功能,因此合作团队预测该酶的功能是dATP水解酶。该预测得到了酶活实验验证,因此该酶被重命名为dATPase。dATPase可以水解dATP/dADP/dAMP,切断的是与脱氧核糖C5’直接相连的磷酸酯键,产物分别是dA和三磷酸/焦磷酸/磷酸。dATPase对其他dNTP及NTP均无作用。合作团队认为,dATPase的作用,是降低dNTP池中的dATP及其前体的浓度,从而使得热力学上和T配对更稳定的Z碱基所对应的核苷dZTP可以被噬菌体的DNA聚合酶选择性使用(注:合作团队使用Q5聚合酶验证过,在dZTP:dATP = 1:1时,PCR产物中只有Z而没有A)。另外一个磷酸酶属于DUF550家族,它是一个焦磷酸水解酶,可以水解dATP/dGTP为dAMP/dGMP和焦磷酸。它的一个作用是进一步降低dATP的浓度,另一个作用是增加dGMP的浓度,而dGMP是PurZ的底物。综上,合作团队发现了一个多酶系统,由PurZ、dATPase 、DUF550和DNA聚合酶这几个来自噬菌体的酶和两个来自宿主的PurB和GK共同组成,负责dZTP的生物合成及其被选择性地整合入噬菌体基因组(图2)。合作团队发现近百个分布在全球各地的噬菌体中都含有该通路的关键基因purZ,并因此推断这些噬菌体也都具有Z-基因组。合作团队选取了其中一个在上海被分离的噬菌体Acinetobacter phage SH-Ab 15497来进行多角度的在体实验验证,所使用实验手段包括液相色谱-紫外联用,液质联用,和纳米孔测序。这些实验都验证了该噬菌体具有Z-基因组,这是第二个被实验验证的具有Z-基因组的噬菌体,而噬藻体 S-2L是此前唯一已知具有Z-基因组的物种。这证明了Z-基因组噬菌体在大自然中存在的广泛性。图3. 具有Z-基因组的噬菌体广泛分布在全球各地。合作团队进一步验证了Z-基因组的生物学意义。通过使用来自宿主的限制性核酸内切酶和一系列其他内切酶对Acinetobacter phage SH-Ab 15497的Z-基因组的切割实验,合作团队确认,识别位点中含有A的限制性核酸内切酶无法切割Acinetobacter phage SH-Ab 15497的Z-基因组。因此,Z-基因组的生物学意义是使得噬菌体可以逃避宿主内切酶的剪切,从而赋予噬菌体演化上的优势。综上,合作团队对Z-基因组合成通路、存在的广泛性、及生物学意义的研究,使得大规模合成Z-DNA从而展开各种应用研究如噬菌体疗法、合成生物学和DNA存储等成为可能。该工作由来自多家单位的研究人员合作完成。天津大学药学院的博士生周彦,上海科技大学iHuman研究所和生命学院的博士生许雪霞,以及新加坡A*STAR研究所的魏易峰博士为文章的共同第一作者。A*STAR/UIUC的赵惠民教授,天津大学的张雁教授和上海科技大学的赵素文研究员为文章的共同通讯作者。文章的共同作者还包括,上海科技大学iHuman研究所和生命学院的研究生成语和郭昱,免疫化学研究所生物大数据平台的宋张悦;天津大学质谱平台的李鸷和高妍;全俄罗斯农业微生物研究所的Ivan Khudyakov,作为第一个Z-基因组的发现者,也对本研究提出了很多宝贵的建议;上海交通大学的何平教授和刘福莉同学则为本研究提供了提取自Acinetobacter phage SH-Ab 15497的Z-DNA。上海科技大学iHuman研究所的克隆平台,免疫化学研究所的生物医学大数据平台和化学分析平台也为本研究提供了协助。值得一提的是,2021年4月29日,来自法国巴斯德研究所的Pierre Alexandre Kaminski(P.A.K)教授和巴黎-萨克雷大学 Philippe Marliere(P.M.)教授背靠背在Science还发表另外两篇文章和上述工作相似,共同谱写了嘌呤生物合成的第三条路径。详见BioArt今日第二条的推送。https://science.sciencemag.org/cgi/doi/10.1126/science.abe4882